2023年3月9日下午5点左右(美国东部时间),2023年的第2场FDA ODAC(肿瘤药物咨询委员会)会议尘埃落定,专家组以11∶2的比例,
支持基于POLARIX研究的数据结果,维泊妥珠单抗联合利妥昔单抗+环磷酰胺+多柔比星+泼尼松(R-CHP)方案在既往未经治疗的大B细胞淋巴瘤(LBCL)患者中 [ 包括弥漫大B细胞淋巴瘤-非特指型(DLBCL NOS)] 具有理想的获益-风险比。
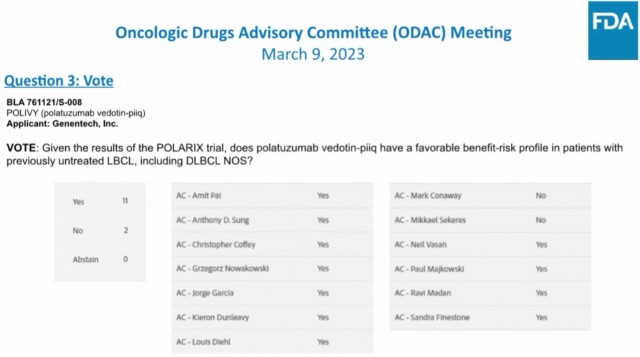
图:ODAC投票结果 针对此次ODAC的讨论议题及投票结果,医药魔方Med公众号联合DeepMed数据库将于
3月22日(星期三)18点30分就弥漫大B细胞淋巴瘤(DLBCL)一线治疗现状及研发格局进行直播讨论,更有
神秘重磅嘉宾做客“DeepMed直播间”,欢迎大家预约观看。
背景回顾 DLBCL作为最常见的非霍奇金淋巴瘤亚型(~40%),尽管R-CHOP方案一线标准治疗疗效显著,仍有约40%的患者复发或原发难治。遗憾的是,过去二十年来,研究者发起若干研究,试图通过强化治疗、巩固治疗、维持治疗、优化抗CD20抗体、联合新型靶向药物等手段提高DLBCL一线治疗效果,但绝大多研究并未展示显著获益。

图:DLBCL一线治疗重要3期临床研究及主要终点结果. 备注:R-ACVBP和HDT/ASCT方案虽然达到主要终点,但前者毒性较大,后者未显示OS获益;来那度胺维持治疗仅在老年患者中显示EFS获益且未显示OS获益。
维泊妥珠单抗(polatuzumab vedotin)是Genentech(Roche)的一款anti-CD79b抗体偶联药物,2019年6月10日,FDA基于GO29365研究加速批准(AA)批准其联合苯达莫司汀+利妥昔单抗(pola-BR)用于既往接受≥2种治疗方案的复发或难治性(R/R)DLBCL NOS。 POLARIX(study GO39942)研究作为后续开展的一项全球多中心、随机、双盲、安慰剂对照的III期确证性研究,既往未经治疗的LBCL患者随机接受维泊妥珠单抗联合R-CHP(Pola-R-CHP)或R-CHOP方案,主要研究终点为PFS,次要终点包括无事件生存(EFS),完全缓解(CR)率,OS和安全性。 2021年ASH大会期间,POLARIX研究公布结果显示,中位随访28.2个月,Pola-R-CHP组患者的2年PFS相比R-CHOP组显著提高:76.7% vs 70.2%(HR=0.73,95%CI 0.57-0.95,p=0.02),但两组OS及CR率未见显著差异。 此次ODAC会议上,进一步长期随访(中位随访时间39.7个月)结果显示,Pola-R-CHP组显示出持久的PFS获益(HR=0.76),OS(HR=0.94,P=0.73) 目前仍未成熟。基于POLARIX研究,Genentech向FDA递交维泊妥珠单抗联合R-CHP用于初治DLBCL成人患者的补充生物制品许可申请(BLA 761121/Supplement 008)。 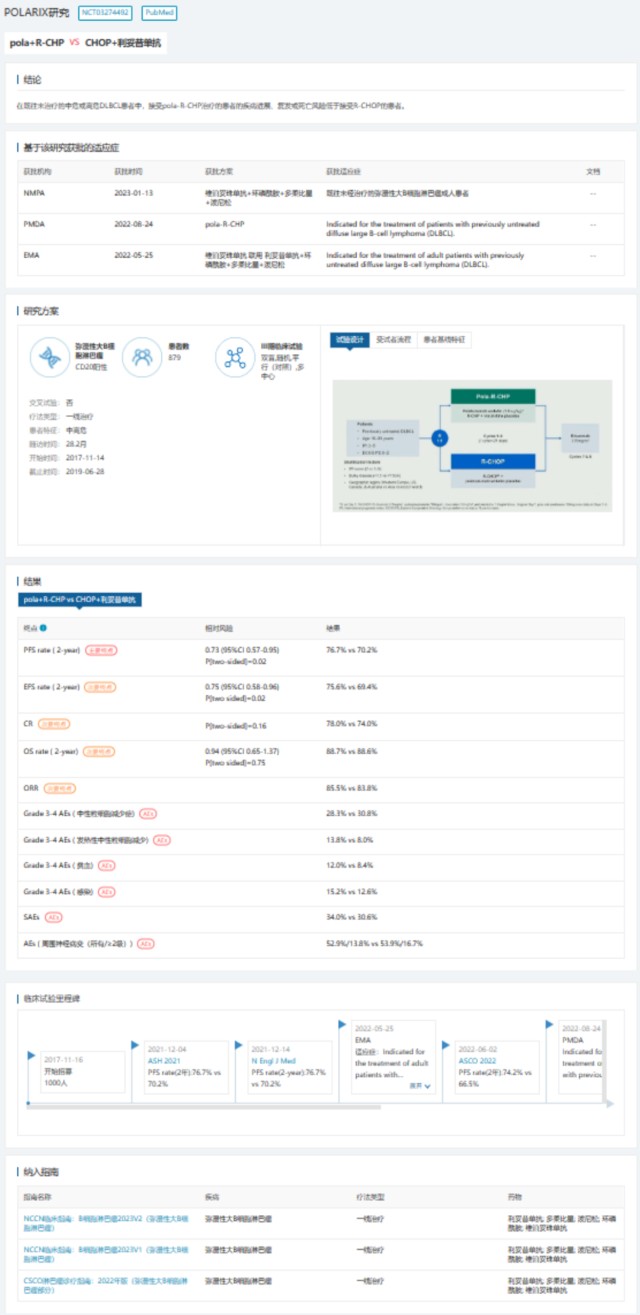 POLARIX研究详情. 图片来自:DeepMed数据库
POLARIX研究详情. 图片来自:DeepMed数据库
基于POLARIX研究,pola-R-CHP方案已被>60个国家批准用于DLBCL的一线治疗,包括欧洲国家、加拿大、日本和中国,并在多个临床实践指南中得到认可(魔方补充:欧洲、日本及中国分别于2022-05-25、2022-08-24及2023-01-13批准维泊妥珠单抗的一线DLBCL适应症,目前该方案已被纳入CSCO及NCCN等多项指南)。
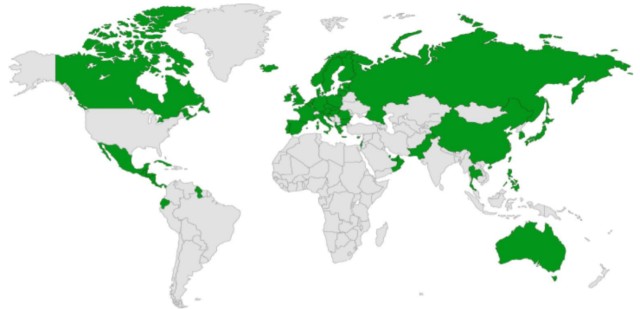
pola-R-CHP一线DLBCL全球获批情况
FDA:Modest PFS benefit,No improvement in OS 会议伊始,FDA重申用于新药审评的证据标准:充足的信息证明药物在目标条件下的
安全性;充分且良好的对照条件下药物在目标条件下显示
疗效,并且对于
支持审评的单一随机研究,
结果必须足够稳健且令人信服(sufficiently robust and compelling)。并就以下FDA关心的问题展开说明:
1、Pola-R-CHP组适度的(modest)的PFS获益: 尽管Pola-R-CHP组相比R-CHOP组显示出统计学意义上的PFS获益,但这一获益程度是适度的(modest):HR= 0.73,95%CI 0.57-0.95,P=0.0177(双侧=0.05)。相比对照组,Pola组的1年和2年的PFS率改善分别为4.1%和6.5%。这种程度的PFS改善是否具有临床意义,还需要结合其他有效性数据来综合考虑,包括OS和安全性。FDA进行了多种敏感性分析以评估PFS结果的稳健性,但无论采用哪种方法,HR置信区间的上限均接近或超过1,并且PFS获益未能转化为CR率和OS的获益。
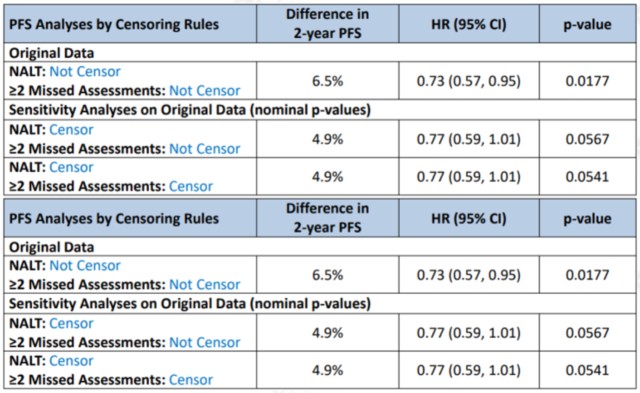
PFS敏感性分析. 图片来自FDA 2、OS结果: 预先设定的最终OS分析中,中位随访39.7个月,Pola-R-CHP组未能证明具有统计学意义的OS获益(HR=0.94,95%CI:0.67-1.33),而在较早的评估时间点,Pola-R-CHP组OS率在数值上甚至低于R-CHOP组。其中占比最高的DLBCL NOS亚型的HR为1.02。OS未显示获益是安全性及疗效的缺陷,尤其在LBCL一线治疗背景下,并且增加了获益-风险的不确定性。FDA并不同意对于初治LBCL患者,PFS是OS确定的替代终点,此外,FDA再次强调其需要OS数据来支持常规批准。
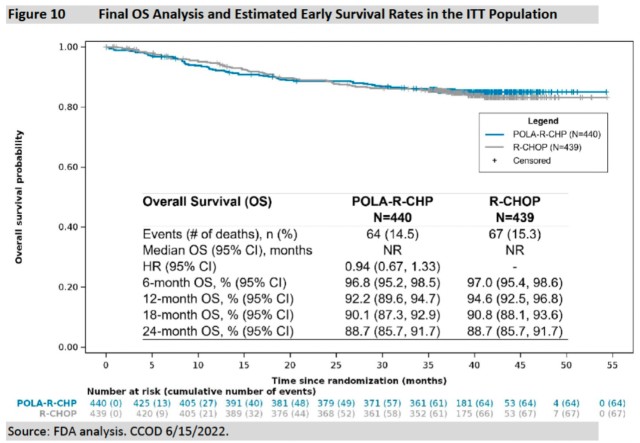
POLARIX研究最终OS结果
3、其他有效性终点指标: 其他终点指标虽然有支持作用,但仍具有局限性。EFS结果虽然有统计学显著性(HR=0.75,95%CI:0.58-0.96,P=0.0244),但获益是适度的,2年获益程度为6.2%。治疗结束时两组间CR率(78.0% vs 74%,P=0.1557)及ORR(84.5% vs 80.9%)均未显示统计学差异,仅数值上的增高并不具有支持性。2年的DFS(81.8% vs 77.4%)和DOR(75.7% vs 71.7%)同样仅显示适度获益,并且由于未控制I类错误,只能认为是探索性分析。
4、研究人群的异质性: DLBCL内部具有极大的异质性,无论POLARIX研究还是拟申请的适应症均为广泛意义的DLBCL(FDA认为应为LBCL),包括DLBCL NOS,高级别B细胞淋巴瘤(HGBL)伴MYC和BCL2和/或BCL6重排以及HGBL NOS,以及其他LBCL类型(富含T细胞/组织细胞LBCL,EBV+ DLBCL,ALK+ DLBCL和HHV8+ DLBCL),POLARIX研究中并未纳入所有组织学亚型的患者。
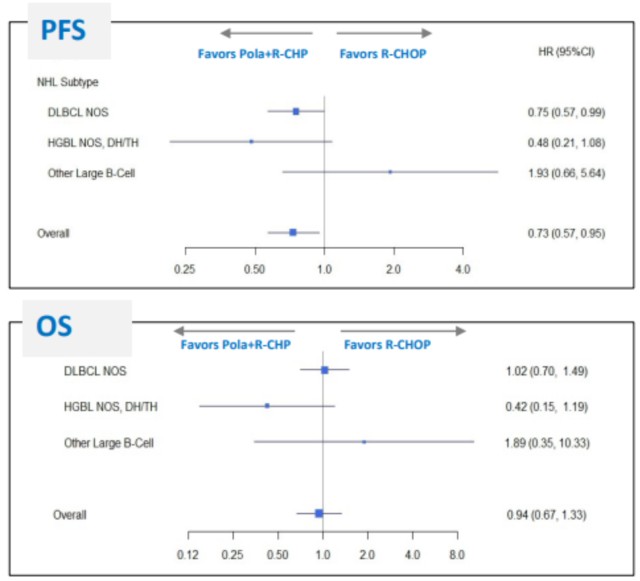
POLARIX研究人群中84%是DLBCL NOS,11%是HGBL NOS或HGBL伴MYC和BCL2和/或BCL6重排,5%为其他类型的LGBL。维泊妥珠单抗在各亚型中的治疗效果存在异质性,PFS的HR值在DLBCL NOS,HGBL,其他LBCL中分别为0.75,0.48和1.93。OS的HR值分别为1.02,0.42和1.89。需要注意的是,由于样本量的限制,这只是探索性的事后分析。结果提示,在HGBL亚组中,维泊妥珠单抗联合R-CHP显示出获益趋势,包括CR率。值得注意的是,
对于HGBL,R-CHOP并非最“理想的”治疗方案,临床实践中通常推荐更强的治疗方案。针对占比最大的DLBCL NOS患者,所有的终点指标都是临界的或没有明确积极的获益。此外,由于置信区间较宽,评估仍有高度的不确定性。
FDA同样指出,POLARIX研究试图用维泊妥珠单抗替代R-CHOP方案中的长春新碱,但由于既往研究并未探讨长春新碱在R-CHOP方案中作用,这一“替代策略”很难解释维泊妥珠单抗在其中的贡献。另外,尽管两组的整体安全性相似,但在pola-R-CHP组的发热性中性粒细胞减少症、感染、恶心和腹泻发生率至少增加5%。两组周围神经病变的发生率相当(53% vs 54%),但pola组解决率更低(58% vs 67%)。并且,FDA认为在前期研究中,并未在初治DLBCL患者中进行足够的剂量探索。
申办方:Clinically meaningful benefit,Best chance of cure 对于DLBCL患者,疾病进展和复发是他们最关心的问题,后续治疗(例如CAR-T等)增加了负担。改善一线治疗方案以治愈更多DLBCL患者,仍是一个重要的未满足的需求。 作为20年来首个在DLBCL一线治疗中获得积极结果的III期临床研究,POLARIX研究证明了具有统计学意义的PFS获益,pola-R-CHP相比R-CHOP方案降低了27%的疾病进展、死亡或复发的风险,达到了“
临床有意义的PFS目标(Clinically meaningful PFS target:)”:降低25%的疾病进展、复发或死亡的风险,并转化为5-7%的24个月PFS改善。假设美国有27,360例初治DLBCL患者,pola-R-CHP组显示出的6.5%的2年PFS改善可预防1,700多例患者每年发生疾病进展或复发。此外,pola-R-CHP组的安全性与R-CHOP相当,自2019年获得AA以来,已有超过1.2万名患者接受了维泊妥珠单抗治疗。
POLARIX作为一项全球多中心研究,与淋巴瘤研究协会(LYSA)和淋巴瘤学术研究组织(LYSARC)合作进行,同时有一个由全球著名淋巴瘤专家组成的指导委员会,共同参与POLARIX研究的设计和执行,并和FDA保持密切沟通。既往研究表明,如果以OS为终点的III期临床试验大约需要10年时间才能完成。PFS作为明确且被广泛认可的终点,POLARIX研究与大多数其他研究一样,选择PFS做为主要终点,并且长期随访结果显示,Pola组相比对照组具有持续的PFS获益。OS作为关键次要终点,尽管尚未显示统计学差异,但中位随访~40个月,只有~15%的入组患者死亡,目前OS尚不成熟,需结合其他预先指定的次要终点作为补充PFS临床获益的证据。
其他次要终点结果显示,EFS有统计学意义的改善。CR率虽未达到统计学意义(双侧p值=0.1557),但在治疗结束时,pola-R-CHP组的CR率在数值上更高,为78.0%(95%CI 73.8-81.7),而R-CHOP组为74.0%(95%CI 69.7-78.1)。同样,治疗结束时的ORR在数值上也更高,分别为84.5%(95%CI:80.8-87.8)和80.9%(95%CI:76.9-84.4)。值得注意的是,pola-R-CHP组患者的缓解时间更持久。两组的安全性总体相当,虽然发热性中性粒细胞减少症和感染的发生率在维泊妥珠单抗联合R-CHP组较高,但并没有增加患者的死亡率。两组患者的生活质量报告结局结果也相似。因此,申办方认为总体来说,维泊妥珠单抗联合方案具有临床意义的获益且有和R-CHOP相似的安全性。
 11 ∶ 2,支持基于POLARIX研究,Pola-R-CHP在初治LBCL患者中(包括DLBCL NOS)具有理想的获益-风险比
11 ∶ 2,支持基于POLARIX研究,Pola-R-CHP在初治LBCL患者中(包括DLBCL NOS)具有理想的获益-风险比 FDA及申办方发言结束后,与会专家就多项问题展开激烈讨论,包括不同IPI患者的PFS及OS情况,研究过程中病理检测的具体细节,HGBL患者接受R-CHOP方案作为对照组的合理性、接受pola-R-CHP治疗患者的复发模式、何为“Modest”以及“Clinically meaningful”,适合或不适合接受pola-R-CHP治疗的患者人群等等,并最终就以下两个会前预设的问题表达看法:
一:结合POLARIX研究的结果,评估维泊妥珠单抗联合R-CHP方案在LBCL患者(包括DLBCL NOS)的获益-风险情况。
二:基于POLARIX研究数据,尤其是OS结果,是否需要额外的随访数据来明确维泊妥珠单抗在LBCL前线治疗中的获益-风险情况。
针对第一个问题,专家组同意PFS是一个明确的且被美国及全球血液学专家认可的终点指标,但对于POLARIX研究中采用当地病理检测的方式、对照组HGBL患者是否接受合适的治疗方案以及研究人群的异质性的治疗表示担忧。而针对第二个问题,专家组表示PFS并不能充分说明“livelonger,live better”的结果,还需要OS及QoL的数据支持;但基于目前OS的KM曲线,专家组担心更长时间的随访并不一定能显示出OS的差异,尤其既往研究表明达到2年PFS患者的生存曲线与预估水平基本一致,更长期时间的随访可能让那些期望降低2年内疾病进展的风险的患者无法用药,也可能错过维泊妥珠单抗治疗的真正价值所在。 历时约5个小时,最终,共5名ODAC专家及8名特邀专家(包括实体瘤专家,血液瘤专家,患者教育工作者,生物统计师,临床药学专家、转化医学专家和患者代表)以11 ∶ 2支持基于POLARIX研究,Pola-R-CHP在初治LBCL患者中(包括DLBCL NOS)具有理想的获益-风险比。虽然ODAC的结果并不一定代表最终FDA的意见,但经过这次讨论,DLBCL一线治疗曙光已现。
POLARIX研究详情. 图片来自:DeepMed数据库
